Les protéines
Les aliments d’origine végétale peuvent parfaitement couvrir nos besoins en protéines. On trouve des protéines dans tous les aliments (à l’exception du sucre, de l’huile, et des alcools distillés). Les plus riches sont les légumineuses (tels que les pois, les lentilles, les haricots, le soja et ses dérivés), les fruits oléagineux (comme les noix, les noisettes ou les amandes), le seitan (simili-carne à base de gluten), le quinoa. On recommande trois à quatre portions d’aliments riches en protéines par jour (légumineuses + oléagineux).
Il n’est pas nécessaire pour un-e végétalien-ne d’effectuer des combinaisons céréales/légumineuses à chaque repas pour couvrir ses besoins en acides aminés, ni de manger plus de protéines que les personnes consommant des produits animaux. Les études réalisées sur les végétalien-ne-s ont montré qu’ils-elles couvraient sans difficulté leurs besoins.
Les besoins d’un adulte sont de 0,8 g par kg de poids corporel de forme. Soit 56 g pour un adulte de 70 kg.

1. Qu’est-ce qu’une protéine ?
Les protéines sont des molécules organiques azotées formées de chaînes d’acides aminés (de quelques-uns à plus de 30 000). Elles ont de très nombreuses fonctions chez tous les êtres vivants et sont essentielles au fonctionnement des cellules. C’est pourquoi on en trouve dans tous les organismes, que ce soient les animaux, les végétaux, les champignons ou les micro-organismes. Les gènes sont la recette de fabrication des protéines.
1.1. Les acides aminés
Les acides aminés sont les constituants élémentaires des protéines. Ils tirent leur nom de leur groupe amine (-NH3), que les plantes fabriquent à partir de l’ammoniac, des nitrites ou des nitrates. Les animaux peuvent produire des acides aminés à partir d’autres acides aminés mais ne peuvent fabriquer de groupe amine primaire. Ils doivent donc consommer des acides aminés. La digestion décompose les protéines des aliments en acides aminés.
Les acides aminés dit « standards » entrent dans la composition des protéines et sont au nombre de 20. On trouve ces 20 acides aminés dans tous les aliments, et plus généralement dans la totalité des êtres vivants de la Terre.
En effet, l’ADN (acide désoxyribonucléique) contient la recette de fabrication des protéines. L’ADN se compose de briques élémentaires, les nucléotides, au nombre de quatre : adénine, cytosine, guanine, thymine. Chaque acide aminé est symbolisé par une suite de trois nucléotides appelée codon. La séquence complète d’une protéine s’appelle un gène. Les gènes sont bornés par des codons « stop ». L’ARN (acide ribonucléique) permet de transférer l’information contenue dans l’ADN aux ribosomes, l’endroit dans les cellules où les protéines sont fabriquées.
Ce système est universel : on trouve de l’ADN et de l’ARN dans toutes les cellules vivantes, les 20 acides aminés standards sont symbolisés par les mêmes codons chez tous les êtres vivants. Cette universalité permet la transgénèse, c’est-à-dire l’insertion d’un gène d’un être vivant dans le génome d’un autre. Par exemple, le gène codant pour la syncytine, une protéine essentielle à la formation du placenta chez les mammifères, provient d’un rétro-virus, un virus insérant ses gènes dans le noyau des cellules. À l’origine cette protéine servait au virus à se protéger du système immunitaire de son hôte ; elle sert désormais à éviter au placenta, dont les cellules proviennent du fœtus, d’être attaqué par le système immunitaire de la mère. Plus généralement, 10% de notre ADN (voire davantage) provient de virus qui ont squatté nos ancêtres au cours de l’évolution (tous les virus ne sont pas pathogènes, beaucoup font de leurs hôtes des porteurs sains).
Il existe par ailleurs trois acides aminés protéinogènes non-standards, d’occurrences rares, qui ne sont pas directement codés par l’ADN, et que l’on trouve surtout chez des micro-organismes (bactéries et archées). L’un d’entre eux est utilisé aussi par les eucaryotes, donc les humains : la sélénocystéine. Elle est synthétisée au moment de la fabrication des quelques enzymes l’utilisant, car elle est toxique à l’état libre. Celle des aliments n’est pas assimilée (le corps se contente d’en extraire le sélénium). Donc, les seuls acides aminés pertinents d’un point de vue nutritionnel sont les 20 acides aminés standards.
1.2. Les acides aminés essentiels
On appelle « acides aminés essentiels » ceux qu’un animal ne peut pas synthétiser, ou pas en quantité suffisante, à partir d’autres acides aminés. Dix sont essentiels chez la plupart des animaux [4] comme les cochons, les rats, les chiens, les chevaux, les chats, les lapins, les poules, les insectes (Nation, 2002)… Seuls neuf sont essentiels chez les humains [5] car certains mammifères, dont les primates, peuvent synthétiser l’arginine en quantité suffisante (Tapiero, 2002).
Ces acides aminés essentiels sont : l’histidine, l’isoleucine, la leucine, la lysine, la méthionine, la phénylalanine, la thréonine, le tryptophane, la valine. Comme tous les êtres vivants contiennent les 20 acides aminés standards, tous les végétaux contiennent a fortiori tous les acides aminés essentiels. On peut consulter la base de données de l’USDA pour le vérifier.
La proportion des différents acides aminés peut varier d’un aliment à l’autre, mais cela n’a pas d’incidence pratique, car nous mangeons plus de protéines que nos besoins, nous mangeons plusieurs sortes d’aliments au cours de la semaine, et les acides aminés essentiels sont présents dans la plupart des aliments en quantité supérieure à nos besoins (OMS, 2007, p. 151) [6]. Par exemple, nos besoins journaliers en tryptophane sont de 4 mg/kg de poids corporel, soit 0,5 % des acides aminés ingérés. Or les protéines des aliments contiennent en moyenne plus du double (1 % des acides aminés) [7].
Il est donc inutile, en pratique, de réaliser des combinaisons céréales/légumineuses à chaque repas (ADA, 2009).
2. Couvrir ses besoins en protéines
2.1. Apports recommandés
Les apports journaliers recommandés par l’OMS (et les agences sanitaires nationales comme l’ANSES en France) sont de :
-
0,8 g par kg de poids corporel pour les adultes. Il s’agit du poids de forme : l’obésité n’augmente pas plus les besoins en protéines que la maigreur ne les diminue.
-
0,9 g/kg pour les enfants de plus de deux ans et les seniors.
-
1 g/kg pour les enfants de moins de deux ans et les femmes enceintes.
-
1,2 g/kg pour les sportifs.
Ces besoins sont facilement couverts par une alimentation équilibrée. Dans les pays riches, les personnes consommant des produits animaux comme les végétariens consomment, en moyenne, plus de protéines (170 % et 130 % respectivement) que les apports recommandés (Young et Pellett, 1994 ; AFSSA, 2007). On peut consommer jusqu’à deux fois l’apport recommandé sans effet négatif (OMS, 2007, p. 232-233) : l’excédent est simplement dégradé par le foie, produisant de l’énergie (environ 4 kcal/g de protéines) et des déchets azotés que l’on élimine via les reins.
L’origine des protéines ingérées (animales ou végétales) ne modifie pas les besoins (Rand, 2003 ; OMS, 2007, p.111-112). Aussi les végétarien-ne-s n’ont-ils pas besoin de plus de protéines que les non-végétarien-ne-s.
Notons que certaines études suggèrent qu’il est bénéfique à la santé (des os et des muscles, notamment) de consommer un peu plus de protéines que les recommandations, en particulier chez les personnes âgées (Gaffney-Stomberg et al., 2009) et ceux qui ont une alimentation très riche en fibres, fibres qui réduisent légèrement la digestibilité des protéines (OMS, 2007, 6.1.1. ; Norris et Messina, 2011, chp. 2).
2.2. Apport sous-optimal
Les carences sévères en protéines sont très rares dans les pays développés, et ne surviennent que dans les cas pathologiques de dénutrition. Par contre, un apport légèrement insuffisant est possible en cas de simple déséquilibre alimentaire. Même si la plupart des aliments contiennent, en proportion de l’apport calorique, plus de protéines que nos besoins, certains aliments, comme les fruits aqueux et le manioc, en contiennent moins, et certains, comme le sucre et l’huile, n’en contiennent pas. Une alimentation végétalienne riche en huile et en sucre, ou composée majoritairement de fruits aqueux, peut ne pas apporter assez de protéines. C’est pourquoi il est recommandé d’inclure des aliments riches en protéines dans son alimentation.
Un apport insuffisant en protéines a des conséquences négatives sur la masse musculaire, la solidité des os et le système immunitaire.
2.3. Qu’en est-il de l’excès de protéines ?
Il est pratiquement impossible de consommer trop de protéines avec une alimentation normale. L’excès de protéines (plus du tiers de l’apport énergétique journalier) provoque des troubles (nausées, vomissements, fatigue, appétence très forte pour les aliments sucrés et gras…) appelés « famine du lapin » ou « mal de caribou » [8], quand la capacité maximale du foie à dégrader les acides aminés est dépassée.
Une consommation de protéines inférieure ou égale à 2 g de protéines par kg de poids corporel et par jour, soit environ 25% de l’apport calorique total, n’a pas d’effet négatif attesté (chez les adultes ayant une fonction rénale normale). 2 g de protéines par kg/j est d’ailleurs l’apport maximal tolérable (= sans danger connu) fixé par l’OMS.
Statistiquement, la consommation de protéines est associée à une élévation du taux de mortalité, au-delà d’une certaine dose. Mais cette corrélation n’est valable que pour les protéines animales (Sun, 2012), par conséquent ce ne sont vraisemblablement pas les protéines en tant que telles mais d’autres composants des produits animaux qui ont des effets négatifs, comme les acides gras saturés, le fer héminique, la partie brûlée des viandes grillées, les nitrosamines des charcuteries, le sel des charcuteries et fromages, ou encore la carnosine (Koeth et al., 2013).
Certains chercheurs pensent que les protéines animales en tant que telles pourraient être nocives (à partir d’une certaine dose) car riches en un acide aminé, la méthionine, qui stimule la croissance des cellules cancéreuses lorsqu’il est consommé en excès (Cavuoto et Fenech, 2012).
2.3. Les aliments riches en protéines
Les aliments les plus riches, que l’on range dans la catégorie nutritionnelle « riches en protéines », sont les légumineuses et les oléagineux. Suivent les céréales. Les légumes verts sont aussi une source non négligeable de protéines ; ce sont même les plus riches en pourcentage de l’apport calorique (mais ils apportent peu de calories donc quantitativement peu de protéines : dans une alimentation normale ils ne fournissent que 10 à 20% de l’apport en protéines).
| Aliment |
Protéines en grammes / 100 g d’aliment cuit (sauf mention contraire) |
|
Légumineuses |
|
|
Arachides (crues) |
25,2 |
|
Tempeh |
18,5 |
|
Steak de soja |
15 |
|
Tofu |
12,6 |
|
Pois chiches |
8,9 |
|
Haricots rouges |
8,5 |
|
Haricots blancs |
8,5 |
|
Pois cassés |
8,3 |
|
Lentilles vertes |
8,2 |
|
Lentilles corail |
7,6 |
|
Petits pois |
5,2 |
|
Flageolets |
4,1 |
|
Lait de soja |
3,7 |
|
Céréales et assimilé |
|
|
Seitan (gluten de blé) |
23 |
|
Pain multi-céréales |
11 |
|
Pain blanc (baguette) |
8,6 |
|
Pain complet |
8,4 |
|
Pain de seigle |
7,2 |
|
Semoule |
6,7 |
|
Pâtes complètes |
5,3 |
|
Polenta |
4,4 |
|
Quinoa |
4,4 |
|
Pâtes blanches |
4 |
|
Riz sauvage |
4 |
|
Boulgour |
3 |
|
Riz complet |
2,4 |
|
Riz blanc |
2,3 |
|
Orge |
2,3 |
|
Tubercules |
|
|
Patates douces |
2 |
|
Pommes de terre |
1,9 |
|
Oléagineux (crues) |
|
|
Arachides |
25,2 |
|
Graines de courges |
24,5 |
|
Amandes |
23,6 |
|
Noix de cajou |
22,4 |
|
Lin |
19,8 |
|
Pavot |
18 |
|
Sésame |
17,7 |
|
Chia |
15,6 |
|
Noix de Grenoble |
15 |
|
Noisettes |
15 |
|
Noix de macadamia |
8 |
|
Légumes |
|
|
Ail cru |
7,1 |
|
Pleurotes crues |
3,3 |
|
Artichauts |
2,9 |
|
Brocolis |
2,8 |
|
Roquette crue |
2,6 |
|
Choux-fleurs crus |
2,4 |
|
Mâche crue |
2 |
|
Betteraves |
2 |
|
Topinambours |
2 |
|
Avocats |
2 |
|
Choux-fleurs |
1,9 |
|
Choux frisés |
1,9 |
|
Champignons shiitaké |
1,6 |
|
Choux rouges crus |
1,5 |
|
Champignons de Paris (en boite) |
1,5 |
|
Choucroute |
1,5 |
|
Épinards |
1,4 |
|
Laitues crues |
1,4 |
|
Haricots verts |
1,3 |
|
Choux blancs crus |
1,3 |
|
Rutabagas |
1,3 |
|
Oignons |
1,2 |
|
Tomates (pelées, en boite) |
1,2 |
|
Tomates (pulpe, en boite) |
1,1 |
|
Carottes |
0,8 |
|
Poireaux |
0,8 |
|
Tomates cerises crues |
0,8 |
|
Aubergines |
0,8 |
|
Navets |
0,7 |
|
Courgettes |
0,6 |
|
Fruits (crus) |
|
|
Figues séchées |
3,3 |
|
Kiwis |
1,1 |
|
Bananes |
1 |
|
Oranges |
1 |
|
Raisin |
0,7 |
|
Poires |
0,4 |
|
Pommes |
0,3 |
USDA nutrient database et CIQUAL
3. Un peu de biochimie
3.1 Fonction des protéines
Les protéines ont un rôle si fondamental qu’il est difficile d’en résumer les fonctions. Elles assurent :
-
La structure : elles sont responsables de l’architecture interne des cellules (le cytosquelette) ; elles constituent les tissus conjonctifs et la trame des os.
-
Les mouvements : l’actine et la myosine rendent possible le mouvement des cellules et, à une bien plus grande échelle, la contraction musculaire.
-
Le transport de molécules. C’est le cas de l’hémoglobine, qui permet le transport de l’oxygène jusqu’aux cellules, ou encore les apolipoprotéines, qui transportent les graisses dans le sang (qui autrement seraient insolubles dans l’eau).
-
Le passage transmembranaire (à travers la membrane des cellules) de molécules et d’ions.
-
La communication cellulaire. Les membranes des cellules sont tapissées de protéines réceptrices, qui s’activent en présence d’un « ligand ». On compare le ligand et le récepteur à une clé et sa serrure. Les ligands endogènes sont les hormones, les cytokine, les neurotransmetteurs. Les ligands eux-mêmes peuvent d’ailleurs être des protéines ou des acides aminés.
-
La signalisation immunitaire. Les anticorps sont des protéines qui s’attachent à une molécule spécifique (appelée antigène, qui peut être une toxine, un composant de la membrane cellulaire d’une bactérie, un allergène, etc.), permettant au système immunitaire de détecter les intrus et de les détruire.
-
Les réactions chimiques. On appelle enzymes les protéines qui catalysent les réactions chimiques [1].
3.1. Structure des acides aminés
Ceci est la structure générique des acides aminés. Ils possèdent deux groupes fonctionnels : un groupe amine (NH2, en bleu) et un groupe carboxyle (COOH, en rouge). Ils possèdent aussi un chaîne d’atomes appelé le radical (noté R, en vert), qui varie d’un acide aminé à l’autre. Voici par exemple une molécule de lysine.
Le premier carbone en partant du groupe carboxyle est appelé α, le second (s’il y en a un) β, etc. Tous les acides aminés des protéines sont α-aminés, ce qui signifie que le 1er carbone est lié à un groupe amine (appelé de ce fait groupe amine alpha). On constate que la lysine est également ε-aminée (un groupe amine est lié au 5e carbone).
3.2. Acides aminés non protéinogènes
Il existe d’autres acides aminés, qui n’entrent pas dans la composition des protéines. Aucun acide aminé non protéinogène n’est essentiel (nous fabriquons tous ceux dont nous avons besoin). Il peut s’agir d’acides a-aminés mais aussi d’acides β-aminés, γ-aminés, etc, comme la β-alanine, la β-lysine (un antibactérien fabriqué par les plaquettes sanguines) ou l’acide γ-aminobutyrique (un neurotransmetteur).
3.3. Propriétés chimiques et classification
On peut classer les acides aminés selon plusieurs critères : la charge acide, la polarité, l’aromaticité, la chiralité.
La charge acide
Les acides aminés possèdent une fonction acide, le groupe carboxyle, mais également une fonction basique, le groupe amine, de sorte que la plupart sont en fait globalement neutres. Voici la formule générique d’un acide aminé sous forme non-ionisée (1) et ionisée (2) :
Au pH physiologique, les acides aminés sont sous forme ionique.
Un acide est une espèce chimique capable de donner un proton (ion H+), une base est une espèce chimique capable de recevoir un proton. Dans le schéma (2), le groupe carboxyle a perdu un proton (il est donc chargé négativement), le groupe amine en a gagné un (il est donc chargé positivement). Un acide ayant donné un proton est une « base conjuguée », une base ayant reçu un proton est un « acide conjugué ». Un acide aminé peut posséder d’autres groupes amines ou carboxyles dans son radical. S’il possède plus d’amines que de carboxyles, alors il est globalement basique. C’est le cas de la lysine, de l’histidine et de l’arginine. S’il possède plus de carboxyles que d’amines, alors il est globalement acide. C’est le cas de l’acide glutamique et de l’acide aspartique.
La polarité (du radical)
La polarité désigne la répartition des charges électriques dans une molécule. Si les charges ne sont pas réparties de manière homogène, la molécule est polaire (certaines zones sont chargées négativement, d’autres positivement). L’eau est une molécule polaire (car l’atome d’oxygène attire davantage les électrons que les atomes d’hydrogène). De ce fait, les acides aminés à radical polaire sont hydrophiles, les acides aminés à radical apolaire sont hydrophobes. On trouve surtout les acides aminés apolaires au centre des protéines, et les acides aminés polaires en périphérie, au contact des molécules d’eau.
L’aromaticité
Certains acides aminés comportent un cycle dit « aromatique ». Les acides aminés n’en comportant pas sont qualifiés d’aliphatiques.
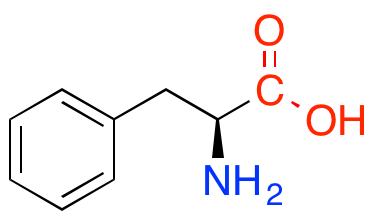
La phénylalanine, un acide aminé aromatique
La chiralité
La plupart des acides aminés sont des molécules chirales, c’est-à-dire qu’elles ne sont pas symétriques et peuvent exister sous deux formes miroirs qu’on appelle les énantiomères. Pour les acides aminés, on utilise la classification L/D. Les acides aminés des protéines sont de la série L, d’où les termes de L-lysine, L-méthionine, etc. Les acides aminés de la série D ne sont que rarement utilisés par les êtres vivants (on trouve de la D-alanine dans les parois des bactéries et de la D-sérine dans le cerveau des vertébrés, où elle jouerait le rôle de neurotransmetteur). On pense que le « choix » fait par les premiers êtres vivants terriens de la forme chirale L est purement aléatoire ; une biologie à base de carbone utilisant la forme D serait possible. L’ingestion d’acides aminés D n’est pas dangereuse car notre corps possède des enzymes pour les dégrader.
On lit parfois sur les étiquettes (par exemple des croquettes pour chats ou des laits infantiles) « DL » ou « D/L » (par exemple « DL-méthionine »). Lorsqu’on fabrique un acide aminé (ou toute autre molécule chirale) par synthèse chimique (c’est notamment le cas de la méthionine, que l’on ne sait pas fabriquer par fermentation bactérienne), on crée un « racémique », un mélange contenant une proportion égale des deux énantiomères. Comme il est coûteux de séparer les deux énantiomères et que les acides aminés de la série D sont inoffensifs, les fabricants utilisent le racémique pour supplémenter leurs produits.
3.4. Usage abusif du terme acide aminé
Il existe plusieurs molécules parfois qualifiées à tort d’acides aminés. Notamment :
– La taurine
La taurine n’est pas un acide carboxylique mais sulfonique, β-aminé de surcroît. Les humains et les chiens peuvent la synthétiser, mais pas les chats, qui doivent en trouver dans leur alimentation.
– La carnitine
La carnitine est encore plus différente des acides aminés que la taurine. C’est un ammonium quaternaire (groupe N+ et non pas NH2), fabriqué à partir de deux acides aminés (lysine et méthionine). Elle sert à transporter les acides gras dans les mitochondries. Le corps fabrique la carnitine dont il a besoin.
– La créatine
La créatine est une molécule azotée synthétisée dans le foie et les reins. Elle sert, sous la forme de créatine-phosphate (sa forme « chargée » en énergie), de réserve d’énergie immédiatement disponible pour les muscles (elle est utilisée dans les 10 premières secondes de l’effort). Elle se dégrade spontanément et progressivement en créatinine, que les reins éliminent dans l’urine (c’est pourquoi un taux élevé de créatinine dans le sang est révélateur d’un mauvais fonctionnement des reins).
– La carnosine
La carnosine n’est pas un acide aminé mais un dipeptide : un peptide (on utilise ce mot pour désigner les petites protéines) composé de seulement deux acides aminés (β-alanine et histidine). Elle sert entre autres de correcteur d’acidité, dans les muscles notamment.
En nutrition, le terme « acide aminé » sans plus de précision désigne les seuls acides aminés protéinogènes.
Pierre Sigler
Références
-
ADA (2009) : Craig, W.J., Mangels, A.R. and American Dietetic Association. (2009). Position of the American Dietetic Association : vegetarian diets. Journal of the American Dietetic Association, 109(7), pp.1266–1282.
-
AFSSA (2007). Apport en protéines : consommation, qualité, besoins et recommandations.
-
Cavuoto, P. and Fenech, M.F. (2012). A review of methionine dependency and the role of methionine restriction in cancer growth control and life-span extension. Cancer Treatment Reviews, 38(6), pp.726–736.
-
Gaffney-Stomberg, E. et al. (2009). Increasing Dietary Protein Requirements in Elderly People for Optimal Muscle and Bone Health. Journal of the American Geriatrics Society, 57(6), pp.1073–1079.
-
Koeth, R.A. et al. (2013). Intestinal microbiota metabolism of l-carnitine, a nutrient in red meat, promotes atherosclerosis. Nature Medicine, 19(5), pp.576–585.
-
Levine, M.E. et al. (2014). Low Protein Intake Is Associated with a Major Reduction in IGF-1, Cancer, and Overall Mortality in the 65 and Younger but Not Older Population. Cell Metabolism, 19(3), pp.407–417.
-
Nation, James L (2002). Insect physiology and biochemistry. Boca Raton : CRC Press.
-
National Research Council (2005). Dietary Reference Intakes for Energy, Carbohydrate, Fiber, Fat, Fatty Acids, Cholesterol, Protein, and Amino Acids (Macronutrients). Washington, DC : The National Academies Press.
-
Norris & Messina (2011). Vegan for life : everything you need to know to be healthy and fit on a plant-based diet. 1st Da Capo Press ed. Cambridge, MA : Da Capo Press.
-
OMS & Anon (2007). Protein and amino acid requirements in human nutrition : report of a joint WHO/FAO/UNU expert consultation. Geneva : World Health Organization.
-
Rand, W.M., Pellett, P.L. and Young, V.R. (2003). Meta-analysis of nitrogen balance studies for estimating protein requirements in healthy adults. The American Journal of Clinical Nutrition, 77(1), pp.109–127.
-
Sun, Q. (2012). Red Meat Consumption and Mortality : Results From 2 Prospective Cohort Studies. Archives of Internal Medicine, 172(7), p.555.
-
Tapiero et al. (2002). « I. Arginine ». Biomedicine & Pharmacotherapy 56, no 9 (novembre 2002) : 439‑445.
-
Young, V.R. and Pellett, P.L. (1994). Plant proteins in relation to human protein and amino acid nutrition. The American Journal of Clinical Nutrition, 59(5 Suppl), p.1203S–1212S.
Notes
-
Catalyser signifie accélérer une réaction chimique qui aurait lieu spontanément mais très très lentement. Les enzymes accélèrent le processus d’un facteur énorme, jusqu’à 1017, autrement dit ce qui prendrait spontanément un million d’années ne prend qu’une milliseconde en présence d’une enzyme. Les enzymes ne sont pas altérées par la réaction qu’elles catalysent, de sorte qu’une enzyme peut en catalyser plusieurs millions par seconde.
-
Il faut savoir que seulement 1,5 % de notre ADN est composé de gènes. On connaît moins bien la fonction du reste (appelé « ADN non-codant ») mais il semble qu’il joue une fonction d’architecte et de régulation de la croissance et du métabolisme. L’ADN non-codant détermine les traits de notre visage et contribue à l’architecture de notre cerveau, par exemple.
-
À quelques anomalies près chez des micro-organismes particuliers.
-
Le cas des ruminants est particulier puisque, pendant la fermentation, leur microbiote intestinal peut fabriquer certains acides aminés essentiels en quantité suffisante pour couvrir leurs besoins (si d’aventure on leur donne une alimentation artificiellement carencées en acides aminés essentiels).
-
On lit parfois le chiffre de 8, provenant d’études obsolètes. Des études à plus long terme ont montré que l’histidine était un acide aminé essentiel chez les humains.
-
Les exceptions sont le manioc, les patates douces et certaines céréales (le blé notamment) qui contiennent une proportion de lysine inférieure à nos besoins (90 % à 57 %). Le manioc est également pauvre en acides aminés branchés. Aussi, les personnes ayant un régime essentiellement composé de manioc ou de blé, comme cela arrive dans le tiers-monde, ont des besoins en protéines légèrement augmentés.
-
Cf. la base de données nutritionnelles du ministère de l’agriculture américain : http://ndb.nal.usda.gov/
-
L’expression provient du fait que la consommation quasi exclusive de lapin ou de caribou (par les explorateurs de l’Arctique notamment), en particulier en hiver lorsque leurs réserves de graisse sont basses (et que les aliments végétaux sont rares), provoque cette maladie.
